Hacía más de un año que sentía algo adentro, pero como estaba embarazada de su quinto hijo, no se preocupó mucho. Cuatro meses después de parir, el dolor siguió y empezó a sangrar recurrentemente. “Tengo un nudo adentro de la barriga, tiene que vérmelo el doctor” dijo Henrietta al entrar al Hospital Johns Hopkins, sin saber que era el comienzo de su camino hacia la inmortalidad.
El Johns Hopkins ya se había ganado el peso de su nombre pero no por eso dejaba de ser un reflejo de su época, tal vez hasta uno de los más crudos y crueles, donde el color de piel de un paciente podía determinar si eran considerados cobayos válidos.
Si bien era el único hospital gratuito que atendía pacientes negros en Baltimore, tenían un ala específica para no mezclarse con blancos. Fue allí donde la enfermera llevó a Henrietta hacia el consultorio, donde el médico la atendió y encontró una masa dura y erosionada en el cuello de su útero que sangraba con el mínimo roce. Henrietta tenía un cáncer cérvico-uterino. Esta noticia, como sucedía con la mayoría de los pacientes negros con alguna enfermedad, llegó al director del departamento de cultivo de tejidos del hospital, George Gey, que junto a su mujer estaba fanatizado con la idea de inmortalizar células.
La obsesión por los cultivos celulares surgió de otra obsesión, la búsqueda de la inmortalidad. Soñaban con manipular células fuera del cuerpo y ver cómo crecían sin que nada las detuviera. Si eso puede hacerse en una placa de vidrio, ¿por qué no en el cuerpo de pacientes enfermos? ¿Qué tal si podemos implantar células en humanos y renovarlos como si recién hubiesen nacido? Estas ideas se pusieron muy de moda y fueron expuestas en medios masivos de comunicación, generando una idea totalmente equivocada, muy prematura y sin evidencias acerca de un concepto. Cualquier parecido con la homeopatía es pura coincidencia.

A la izquierda, el Dundee Evening Telegraph anunciando el descubrimiento en 1934, adelantándose 20 años a Henrietta y con mayor precisión que todos los horóscopos de la historia. A la derecha, un bigote y un bombín fantásticos.
Hasta ese momento era posible estudiar células humanas fuera del individuo al que pertenecían pero sólo por pocos días, hasta que morían. Lo que buscaban era generar una línea celular que se dividiera continuamente, habiendo descendido de una única célula original. Veían esto como una alternativa para probar tratamientos contra muchísimas de enfermedades, básicamente porque no necesitaban pacientes para los experimentos. Tenerlas hubiese evitado situaciones poco felices, como aquella en la que inyectaron las bacterias responsables de generar sífilis a 600 pacientes negros sin informarles y no los trataron. Para ver qué, ¿vio’?.

Oh, una población que decidimos que no vamos a tratar como personas, hagamos un experimento con ellos!
Gey se llamaba a sí mismo “el buitre más famoso del mundo, que se alimenta de especímenes humanos casi constantemente”. Estamos hablando de médicos que creían que, dado que los pacientes eran tratados de manera gratuita, era justo usarlos como sujetos experimentales a cambio. El mismo médico que atendió a Henrietta dijo “el Hospital Johns Hopkins, con su numerosa población indigente negra, no tenía escasez de material clínico”. Lindo lugar para caer con gripe.
Corrijo: ‘lindo lugar para caer negro y con gripe’.
Henrietta fue informada de su situación y su tratamiento comenzó. La sedaron y el médico a cargo comenzó a tratarla, pero primero (y sin su consentimiento, que el consentimiento es cosa de blancos) recortó un pedazo del tumor y lo guardó en una placa de vidrio.
En un sólo acto inmoral, también se escondía el comienzo de una revolución en la biología celular.
Los pedacitos de Henrietta llegaron hasta el señor y señora Gey, que habían inventado su propio medio de cultivo con plasma sanguíneo de pollo, extracto de fetos de ternero, sales especiales y sangre de cordón umbilical humano. Llegado este punto, me permito una pausa para reflexionar: si este es el que anduvo, lo que habrán sido los que no. Cortaron pedazos del tumor en otros todavía más chicos y los pasaron a una placa nueva con medio de cultivo. Como hacían siempre, lo etiquetaron con las primeras letras del nombre del paciente al que correspondían. Desde ese momento y para siempre, Henrietta Lacks pasaría a ser ‘HeLa’.

Plasma sanguíneo de pollo, extracto de fetos de ternero, sales especiales y sangre de cordón umbilical humano. Un testículo de unicornio, un alita de hada y estamos.
Las gran mayoría de las células sólo puede crecer en cultivos por poco tiempo. Esto es porque con cada división celular se acortan unas partecitas que se encuentran en el final de las hebras de ADN, los telómeros, hasta que llegan a un límite. Eso es una señal para las células que lleva a apoptosis, conocida también como ‘muerte celular programada’. Los telómeros funcionan como indicadores del tiempo que esa célula pasó viva. Cuanto más cortos son, más veces se dividió o, dicho de otra manera, más tiempo pasó viva. Las mutaciones en el ADN se generan por el propio sistema celular y pasan TODO el tiempo. Cuanto más haya vivido una célula, más chances tiene de haber acumulado un montón de mutaciones en sus genes y, como sus telómeros serán muy cortos, esa célula tenderá a morir. Pero no las de Henrietta.
Luego de dos días las células seguían vivas. Las aislaron de a una (diluyendo el medio de cultivo en el cual estaban) en tubos separados. Dejaron pasar un poco de tiempo y empezaron a notar que en algunos de los tubos había muchas: si tenían nutrientes y la temperatura correcta, se duplicaban hasta llenar todo el espacio disponible en la placa. Ese pedacito salido del cuerpo de Henrietta era capaz de crecer sin que nada le importara mucho.
George Gey habló de esto con sus colegas más cercanos, le preguntaron si les prestaba algunas y aceptó. Él no lo sabía, pero las células del tumor de Henrietta tenían una mutación que generaba que sus telómeros sean alargados constantemente, nunca recibían una señal que detuviera su crecimiento. Había encontrado y empezado a distribuir la primera y más popular línea celular inmortalizada de la historia.
Las mutaciones pasan todo el tiempo. Las enzimas que interactúan con el ADN se encargan de traducir su información, duplicarlo o hacerle pequeñas modificaciones. El problema es que, un poco por azar otro poco por contexto, cometen errores. Pueden, por ejemplo, poner moléculas que antes no estaban, eliminar cosas que deberían quedarse, etc. Es TOTALMENTE normal, están hechas de esa manera. Lo bueno es que es uno de los factores que aporta variabilidad a la vida, haciendo que todos los organismos seamos diferentes y evaluados por selección natural. Un poco gracias a esos errores puedo estar escribiendo una nota en este momento y ustedes estar leyéndola. Lo ni bueno ni malo, o sea neutral, es que la gran mayoría de las mutaciones no nos afectan, no cambian la función de un gen, todo sigue como antes. Lo malo es que hay algunas que pueden ser bastante dañinas.
Hoy sabemos que existen varios tipos de tumores que podrían soportar ser pasados a una placa de petri y crecer para siempre. Henrietta fue la primera en la que se encontró y aisló uno, pero (aunque triste), es relevante recordar que podría haber sido otra persona. O, mejor dicho, otro pedacito de persona devenido en tumor. Ahora es más fácil. Tanto que, como sabemos qué es lo que hace que una célula sea inmortal, somos capaces de crear nuevas líneas celulares inmortales todo el tiempo.
Si bien hoy nos resulta trivial, era impensado en ese momento tener algo que se comporta bastante parecido a un organismo humano creciendo en una placa (y ojo, es solamente ‘bastante’, porque de la placa al organismo hay un montón). Podemos manipular estos modelos para entender procesos y solucionar problemas que pasan a un nivel muy chico con una resolución muy grande. El uso de las células de Henrietta explotó desde los ‘50, y es uno de los grandes responsables de los avances en temas relacionados a medicina, biología, etc. Hay más de 75 mil publicaciones que las utilizaron, entre ellas el desarrollo de la vacuna contra el polio y el proyecto ENCODE, que pretende poder construir una lista de todos los elementos regulatorios del ADN.
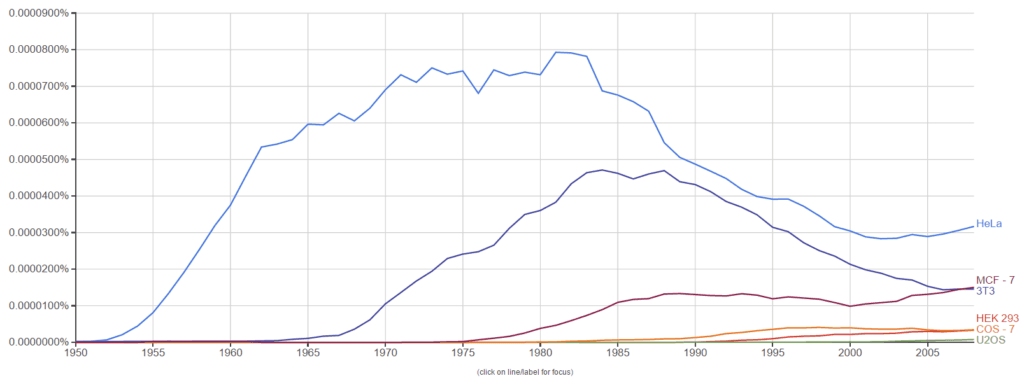
Ngram sobre el uso de distintas líneas celulares inmortalizadas a lo largo de los años. Al momento de producir el gráfico, Mirtha no se encontraba todavía indexada.
En los últimos años las células HeLa empezaron a usarse menos. Esto se debe a que cada vez las investigaciones se especializan más y necesitan modelos mucho más cercanos a lo que estudian: si trabajo en cáncer de mama, voy a buscar trabajar con una línea de células tumorales de este tipo. Y aunque podamos crear líneas celulares nuevas, se piensa que las células de Henrietta tienen tal facilidad para crecer que es difícil encontrar cultivos que no estén contaminadas con ellas.
Henrietta no tenía idea de lo que había pasado con los pedazos que salieron de su cuerpo. Algunas semanas después, una radiografía mostró que el tumor estaba pegado a la pared pélvica, obstruyendo la uretra. Ya era inoperable. Quisieron sacarle más células de nuevo, pero su situación era tan grave que ni siquiera sobrevivieron.
El 4 de octubre de 1951 Henrietta Lacks murió sin saber que un pedacito que había salido de ella iba a encontrarse en casi todos los laboratorios del mundo que usan cultivo celular, en algún freezer de cada instituto de investigación hay, al menos, un tubo con la inscripción “HeLa”.
Su familia se enteró más de 20 años después de que sus células vivían y que cada día había más. Entendían que ella, como un todo, seguía viva y como cada vez tenía más células, pensaban que la habían revivido. Comprender que no era así les costó mucho. Su hija Deborah, por ejemplo, estuvo a punto de sufrir un derrame cerebral por esto. Probablemente no hubiesen sufrido tanto si la comunicación y legislación sobre dónde comienza y termina la vida y sobre los límites de lo que significa ser una persona estuvieran cimentados en evidencias.
Hoy, todas las empresas de suministros de laboratorio del mundo venden sus células, y su familia no recibió nada a cambio. La historia clínica de Henrietta (además de todo su genoma) es de acceso público, de nuevo, sin haber recibido la aprobación de sus familiares.
Las células que empezaron a crecer en el cuerpo de Henrietta Lacks se distribuyeron por todo el mundo. Les hicieron experimentos que modificaron totalmente su genoma. Las enzimas que interactúan con su ADN siguieron generando más y más mutaciones, al punto que si comparamos dos cultivos de HeLa de distintos laboratorios, difícilmente sean idénticos. Entonces ¿cuándo terminó Henrietta y empezó HeLa? ¿Sigue siendo ese el ADN de Henrietta o en algún momento empezó a existir una especie totalmente nueva, generada a fuerza de pasajes, placas y réplicas? Mientras expandimos la frontera del conocimiento cada vez más rápido, tenemos que abrazar la necesidad de discutir con evidencias qué entendemos que es, cuándo empieza y cuándo termina eso que llamamos ‘vida’ y ‘persona’. Diseñar una ética que progrese a la velocidad de una ciencia que no siempre espera a que nuestros conceptos de bien y mal se acomoden para preguntarnos si Henrietta Lacks es realmente inmortal o si murió el 4 de octubre de 1951.




