Todo comienza cuando el nucleolo sale de su nido.
Homero J. Simpson
Pequeña historia de lo pequeño
Si bien esa hubiera sido una linda manera de empezar, lo cierto es que, lamentablemente, la energía nuclear hizo su presentación en público más o menos así:

No exactamente el mejor de los comienzos para una relación.
Así que, antes de hablar de niños pequeños y hombres gordos, vamos a remontarnos un poco en el tiempo. Como muchas historias pochocleras, ‘todo comenzó en la antigua Grecia’. Allá lejos, los tipos pensaron que, si empezaban a dividir la materia en pedacitos cada vez más chicos, llegaría un punto en el que se obtendría una porción que ya no podría fragmentarse. A esta porción la llamaron átomo, que significa literalmente ‘indivisible’.
Por mucho tiempo, no pasó gran cosa (con respecto al concepto de átomo, claro). Hasta que llegamos a principios del siglo XIX, cuando John Dalton (sí, el que además describió el daltonismo) le dio una pincelada científica a esta idea. Él propuso una teoría científica hecha y derecha, planteando que cada elemento era constituido por átomos de un mismo tipo: toda la materia está compuesta por bolitas indivisibles iguales para cada elemento.
Hacia finales de ese mismo siglo, J.J. Thomson (nombre más de basquetbolista que de Nobel de física) descubre el electrón, un ‘corpúsculo’ de carga negativa mucho más pequeño que el átomo más chico conocido: la primera partícula subatómica. Thomson supone entonces que el átomo tiene una estructura interna, que no es taaaaan indivisible como parecía. Se ve que el descubrimiento lo agarró con hambre, porque propone el delicioso modelo del budín de pasas: los átomos son como magdalenas de carga positiva con electrones pasas de uva dispersos en su interior (personalmente, hubiera preferido unos electrones de chocolate para mi átomo).
Entramos entonces al siglo XX. En 1945 caerían las infames bombas nucleares sobre Hiroshima y Nagasaki. H.G. Wells ya había imaginado en 1914 artefactos de enorme poder destructivo, a los que llamó bombas atómicas y no bombas nucleares. Porque, claro ¡el modelo atómico todavía no tenía un núcleo!
¿Y mi núcleo? ¡¿Dónde está mi núcleo?!
El átomo recibe su núcleo de parte de Ernest Rutherford, un discípulo de Thomson. Lo encuentra literalmente de rebote: estaba haciendo el experimento de disparar partículas cargadas a hojuelas delgadas de metales. Pensando en el budin de pasas, esperaba que las partículas que disparaba atravesaran la masa y salieran sin pena ni gloria por el otro lado. Pero lo que encontró es que algunas rebotaban directamente hacia atrás; es decir, estaban golpeando contra algo gordo que las hacía volver por donde vinieron:
“Fue casi el evento más increíble que me haya pasado en la vida, como si dispararas un proyectil de 15 pulgadas a un pedazo de papel tissue y volviera y te golpeara”.
Recuperado de la sorpresa, Rutherford propuso un modelo de átomo con un núcleo central y electrones girando alrededor. Este modelo tenía una falla grosa : si los electrones estuvieran realmente dando vueltas alrededor del núcleo, estarían acelerados. Y dado que toda carga acelerada irradia energía, todos terminarían colapsando en el núcleo.
Para salvar las papas, Niels Bohr le aplica al átomo la última moda del siglo XX: un poquito de cuántica, rompiendo y sin romper nada. La propuesta fue colocar los electrones en órbitas discretas, cuantizadas, y ‘prohibirles’ estar en otro lado. Esto fue un golazo, ya que justificaba algunas observaciones experimentales, aunque también era incompleto: sólo andaba bien para el átomo de Hidrógeno.
Las cosas terminaron de acomodarse con el establecimiento firme de la mecánica cuántica, que involucró entre otros a algunos de los pichones de esta histórica foto:
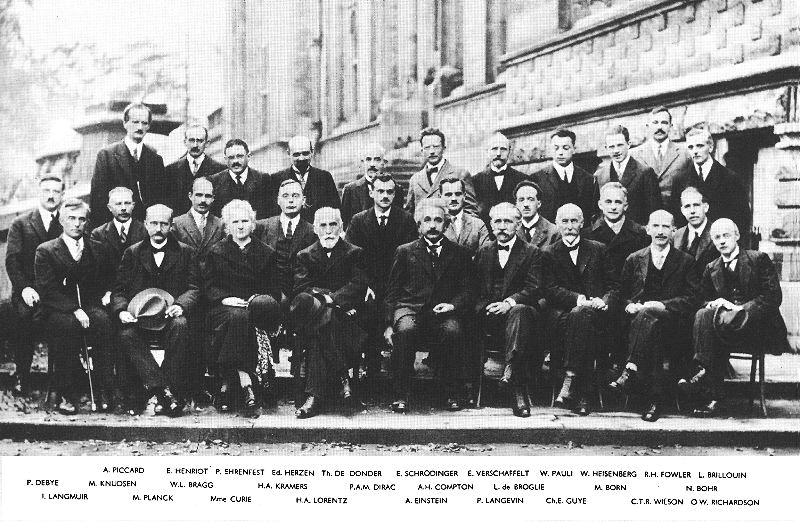
Bruselas (Bélgica), 1927. Acá están posando para la foto ecuaciones, constantes y leyes en su forma humana. Cada uno de ellos hizo aportes invaluables a la ciencia. Notar a la ídola de Maria Salomea Skłodowska (Marie Curie), única pero firme, en medio de un mar de huevos.
El átomo moderno responde a la ecuación de Schrödinger, famoso por su gato y su caja imaginarios, donde ya no sabés exactamente en dónde están los electrones, sino donde es probable encontrarlos. (En realidad esta es una aproximación que funciona a ‘bajas velocidades’. Para energías elevadas se utiliza una versión relativista de la ecuación de Schrödinger, llamada ecuación de Dirac, pero ese ya es todo otro temón).
Volvamos al núcleo. Luego de que Rutherford encontrara que tal cosa existía, se fue desculando que éste a su vez tenía estructura interna. Rutherford mismo comprobó la existencia del protón, que ya se venía barajando desde hacía un tiempo. Lo que encontró es que el átomo de Hidrógeno estaba ‘presente’ en el de Nitrógeno. O sea, que había una bolita primera (en griego, protón) con la que se podía construir el resto de los elementos. El protón tiene carga positiva, y atrae los electrones que están alrededor del núcleo.
Momentito. Si los protones tienen todos la misma carga, ¿cómo es que están apretujados en el núcleo? La razón es que, además del electomagnenetismo, una fuerza que conocemos y con la que convivimos a conciencia, a distancias muuuuy pequeñas (del orden del tamaño de un núcleo atómico) operan otras fuerzas, y una de ellas es la que mantiene los protones pegados a otros protones: la fuerza nuclear fuerte.
Finalmente, llegamos a la estrella de este relato. En 1932 (13 años antes de la bomba), James Chadwick encuentra lo que varios sospechaban que existía: el neutrón. Esta partícula tiene una masa similar a la del protón, pero no tiene carga eléctrica (es neutra). El neutrón, por lo tanto, no es repelido por los protones, pero experimenta la misma fuerza nuclear fuerte que empaqueta al núcleo.
Con este descubrimiento quedaron todas las fichas sobre el tablero, haciendo posible armar el modelo que se mantiene al día de hoy: un núcleo atómico constituido por protones positivos y neutrones sin carga, unidos mediante fuerzas nucleares que contrarrestan la repulsión eléctrica.
La cantidad de protones determina el elemento químico (Plata, Nitrógeno, Litio, Oxígeno, etc, etc), que puede tener un número más o menos variable de neutrones. Los átomos de un mismo elemento con distinta cantidad de neutrones son los dichosos isótopos de ese elemento. Así como en química se ordenan los elementos en la tabla periódica de Mendeleiev, los isótopos se ordenaron en la tabla de Segré.
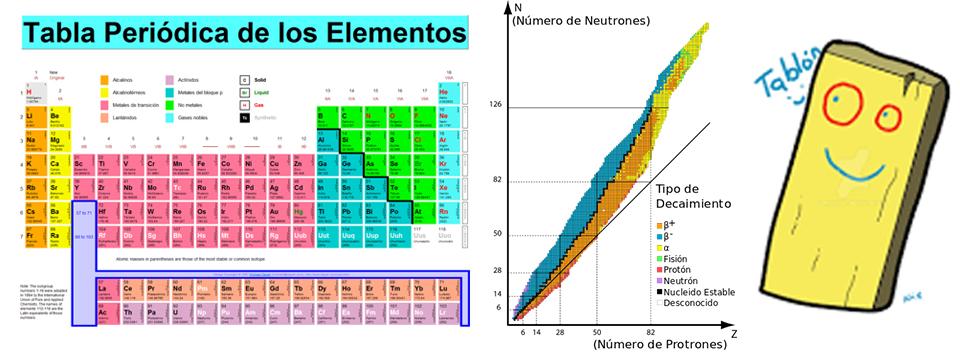
A la izquierda, la tabla periódica de los elementos de Mendeleiev. En el centro, la tabla de isótopos de Segre. A la derecha, un tablón.
Y acá la cosa va tomando pinta: elementos más pesados (con mayor cantidad de protones en el núcleo) ‘necesitan’ mayor cantidad de neutrones que aporten fuerza de unión (y no de repulsión) para mantenerse estables. Estables significa que no se desintegren espontáneamente por la repulsión de los protones entre sí.
El peso de la fuerza
Agarremos la balanza de pesar cosas chiquitas y comparemos la masa de, por ejemplo, dos protones y dos neutrones separados vs. la masa del núcleo de helio (He), que contiene justamente esa cantidad de protones y neutrones. El resultado es este dibujo hecho en paint:

Un núcleo de He, con dos protones y dos neutrones, pesa menos que esas mismas partículas separadas.
¿Qué pasa con la masa que falta? La respuesta está en la famosa ecuación de don Albert Einstein:
E=mc
Esta expresión es tan cortita como extraordinaria por la información que comprime; nos dice que la energía y la masa no son cosas muy diferentes, sino que son equivalentes. Y esto es tan posta que es lo que justifica la diferencia de masa en nuestra balanza. Cuando juntamos las partículas para formar el núcleo de He, una parte de su masa se transforma en energía liberada. El núcleo formado es más estable, dado que liberó energía para formarse. Si lo queremos volver a romper en sus partículas constitutivas, debemos reponer esa energía que fue liberada, por lo que a esta energía se la llama energía de ligadura; es la masa que perdieron los protones y neutrones. Todo muy cuenta de almacén nuclear.
Este tipo de reacción nuclear, donde se juntan cosas chicas para hacer cosas más grandes, se llama fusión. El truco está en que, para lograrlo, hay que convencer a los núcleos de que se acerquen mucho y así actúen las fuerzas atractivas. Y convencer en este caso implica vencer la fuerza de repulsión electrostática. Cuesta, pero se puede. Las estrellas −incluyendo claro nuestro querido Sol− son los reactores de fusión por excelencia. Acá en la Tierra también pudimos lograrlo y se está trabajando actualmente en un reactor de fusión que pueda producir energía de forma eficiente.
Pumba
Fenómeno, junto dos núcleos livianos y tengo uno más liviano que la suma de los dos por separado, ganando energía en el proceso. Así podemos ir cocinando átomos hasta llegar al hierro (Fe). Y acá la cosa se pone peluda para las estrellas que están en la última etapa de su vida, ya que fusionar dos núcleos de hierro cuesta energía. Para los elementos más pesados que el hierro nuestra balanza se invierte: ahora el núcleo más pesado pesa más que los elementos constituyentes. O sea que la ganancia de energía se da rompiendo el núcleo grande en pedazos. Este proceso es la fisión.
Digamos que, ya sea por fusión o por fisión, todos los caminos conducen al hierro: lo que le pase a un átomo (ya sea liberar energía al fusionarse a otro o liberar energía al partirse en varios) depende a grandes rasgos de ser más o menos pesados que el hierro. Cuestión de Fe, que le dicen.
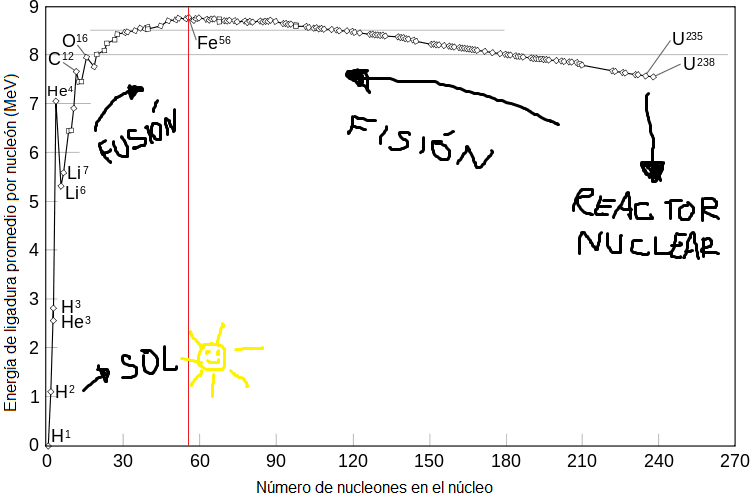
La parte más alta de la curva es la más estable. Los procesos que ‘suben’ en la gráfica dan energía. Dibujo también hecho en paint.
Hay distintas formas de fisionar un elemento. Una buena opción es pegarle con algo para romperlo. El tema es que ‘pegarle’ al núcleo implica tocarlo, y ya vimos que esto es difícil de hacer con cosas cargadas positivamente. Acá es donde entra nuestro héroe, el neutrón. Al ser neutro, puede acercarse al núcleo sin mayor inconveniente y llegar a penetrarlo.
Cuando un núcleo absorbe un neutrón puede tornarse inestable, e incluso puede llegar a romperse en pedazos, que es lo que nos interesa. Recordemos que cuando se rompe en pedazos libera energía. ¿No sería genial encontrar un elemento que además de energía libere algún otro neutrón para que rompa otro núcleo y así seguir produciendo energía? Una pregunta así se hacía Leo Szilard, el húngaro que concibió la idea de hacer una reacción nuclear en cadena en 1933, un año después del descubrimiento del neutrón, pero cuando aún nadie se imaginaba que existiera la fisión. El húngaro cuenta que tuvo ese flash cuando estaba cruzando la calle al cambiar el semáforo a verde, demostrando que veces las epifanías no tienen absolutamente nada que ver con su disparador.
Fue recién a finales de 1938 (7 años antes de la bomba) cuando se descubrió que el Uranio podía fisionar al ser bombardeado con neutrones, y pocos meses después se observó que producía más neutrones al hacerlo. Pero faltaba una vuelta de tuerca que llevó un tiempito encontrar: sólo uno de los isótopos del Uranio era el que fisionaba produciendo más neutrones: el Uranio-235 (92 protones + 143 neutrones).
La diferencia viene dada porque los núcleos, así como los ogros, las cebollas, algunos superhéroes y los orbitales atómicos de los electrones, tienen capas; es decir, niveles permitidos en donde acomodan los nucleones (protones y neutrones). Y así como en química distinta cantidad de electrones en las capas confiere distinto comportamiento químico, el llenado de nucleones en el núcleo tiene un efecto similar desde el punto de vista nuclear. Es así que los núcleos son más o menos estables dependiendo de cuántos nucleones tengan. Y es por esto que algunos isótopos fisionan ‘fácilmente’ cuando les pega un neutrón (como el Uranio-235), y otros no (Uranio-238).
Y como siempre faltan 5 pal peso, más del 99% del Uranio natural se encuentra como Uranio-238, mientras que menos del 1% está en la forma del isótopo ‘útil’ para fisionar. Hay distintas formas de resolver esta imposición de la Pachamama, que llevan a diferentes conceptos de reactores nucleares y quizás a otro artículo entero. Haciéndola corta, hay que concentrar el Uranio-235 o bien disminuir al máximo la pérdida de neutrones.
Lo importante es que el Uranio-235 es capaz de generar una reacción en cadena autosostenida: un neutrón le pega a un Uranio, lo parte al medio y genera más neutrones, que a su vez pueden partir a más núcleos, etc. La cantidad de neutrones generados es 2 o 3, pero no todos los neutrones le van a pegar justo justo a otro Uranio-235: algunos se van a escapar, otros van a ser absorbidos por cosas que no fisionan, a otros te los retiene la aduana. Sin embargo, si armás un sistema en el que en promedio se genere un neutrón por cada uno que consumiste, voilá, tenés un reactor nuclear.
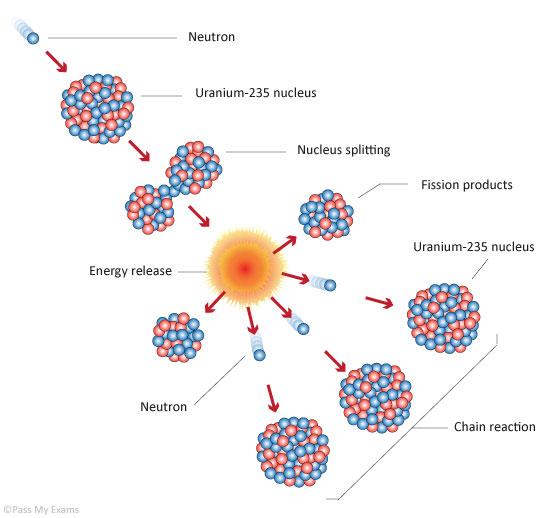
Ahora bien, ¿qué pasa si armo un sistema con mucho Uranio-235, con una geometría tal que muy pocos neutrones se me escapen? En tal caso, una fisión generaría, para poner números redondos, 2 neutrones, que generarían 2 fisiones, que generarían 2 neutrones cada una; 4, luego 8, 16, y el que vio cómo crece una exponencial sabe que la cosa se pone fea muy rápido. Meta el sistema en un recipiente acorde, añada un detonador para activar la reacción en cadena, póngale un nombre pomposo, tírela desde un avión y tendrá una imagen como la del principio del artículo.
(Ojo, el hecho de que un reactor y una bomba atómica funcionen por el mismo fenómeno no implica que un reactor pueda convertirse en una bomba. Las condiciones de uno y otro son muy diferentes, por ejemplo, la concentración de Uranio-235 presente en una bomba −sí, el que fisiona− es unas 20 veces más alta que en un reactor de potencia).
Elemental
Arrancamos en la Antigua Grecia así que, si llegaste hasta acá, tu paciencia para la física, los dibujitos en paint y los chistes malos es una bomba. A mi parecer, el desarrollo del modelo atómico es un exponente hermoso del método científico, con nuevas propuestas, avanzando y naciendo de las falencias de las anteriores. De esta evolución surgió una estructura atómica y se habló por primera vez de un núcleo, naciendo una nueva rama: la física nuclear.
El desarrollo de esta rama tiene como contexto insoslayable la Segunda Guerra Mundial, que estalla a los pocos meses del descubrimiento de la fisión. La Alemania de Hitler hacía tiempo que se estaba preparando para esto. Científicos germano-judíos, y en general los que veían como se venía la mano y tuvieron oportunidad, emigraron a otros países (Einstein se había tomado el palo en 1932). Muchos de ellos son los que contribuyeron luego al desarrollo de la bomba (el tano Enrico Fermi, por ejemplo). El desarrollo en materia nuclear fue un tema estratégico además de científico, por lo que muchos de los avances se realizaron de manera independiente por los países en guerra.
La física de lo chiquito siguió avanzando, claro, y hoy en día los electrones son los únicos que mantienen su estatus de partículas elementales (y ni siquiera eso en las teorías más recientes). Hoy sabemos que los protones y neutrones tienen estructura interna, están formados por partículas más pequeñas: quarks de colores.
O sea que existen partes dentro de las partículas subatómicas, partes que descubrimos partiendo ese átomo al que nombramos, literalmente, por su incapacidad de ser roto en partes más pequeñas.

“Sobrenatural” es tan solo la violación de las leyes.
-¿Por qué se llaman “átomos”?
-Del griego “atomos”, que significa “los indivisibles”.
-¿Podemos dividirlos?
-Sip.
Pasaron varios miles de años entre encontrar una idea, ponerle nombre, buscar evidencia que la respalde y después aprender tanto sobre el tema que la idea detrás del nombre quedó obsoleta y que hace que veamos cuántos años, conocimiento e insistencia va a requerir que los absolutos de nuestra era, las temperaturas de Kelvin, la velocidad de Einstein y los tamaños de Planck se conviertan en Demócritos: adelantados a su tiempo, históricos, pero ahora bautizados en un pasado en el que veíamos el mundo de una manera completamente diferente.






