—y que no puede, sin embargo, ser contenido en palabras
pensado en conceptos
no puede ser siquiera recordado como es.
Es lo que es, y no es mío, y a veces está en mí.
Mario Levrero, El discurso vacío (1996)
En una de las primeras materias de química que cursé en la facultad, tenía un compañero de esos que preguntan todo y a los que ninguna respuesta les viene bien. Un día preguntó: “¿Cómo es, de verdad, un átomo?”, a lo cual Marcos, el ayudante que estaba dando la clase, respondió: “El átomo es lo que es”. O sea, le dijo “dejá de preguntar” de una forma diplomática. Esta insistencia del compañero por encontrar una verdad más verdadera es un ejemplo de algo fundamental que ocurre en muchos desarrollos científicos: necesitamos ponerle cara a algo que no podemos ver, algo que tratamos de entender sin conocer del todo. Como esa idea que nos hacemos de alguien a quien solo conocemos en Internet, armada como una superposición de las fotos que publicó en su perfil de alguna red social.
A lo largo de la historia, mucha gente trató de imaginarse cómo era un átomo usando información que obtenía de manera indirecta porque mirarlo era imposible (hasta hace no mucho). A esas figuras mentales que se fueron haciendo, y que lograban explicar los resultados de sus experimentos, las llamamos ‘modelos atómicos’. Pero la verdad es que el átomo fue, es y será nada más y nada menos que lo que es, como nos decía Marcos. Esto se parece mucho al ‘porque sí’ que le decimos a una criatura de 4 años ante su tedioso ‘¿por qué?, ¿por qué?, ¿por qué?’. Pero claro, ese ‘porque sí’ a menudo no satisface al pequeño inquisidor, y menos a nosotros, porque es la clásica no-respuesta. Necesitamos algo contundente. Algo que nos explique un poco más. Pero ojo: esa explicación va a estar sometida a prueba una y otra vez. Porque por muy buena que sea, no va a ser la posta posta. Va a ser un modelo, una aproximación. Y si sobrevive, digamos, casi cien años, podemos confiar en que es una muy buena.
Indivisible
Lo mejorcito que conocemos hoy en términos de modelos atómicos lo empezaron a plantear alrededor del 1900 y le terminaron de dar forma con el surgimiento de la mecánica cuántica unos treinta años después. Pero antes, mucho antes, Demócrito y otras personas en Grecia habían planteado la existencia de algo muy pequeño: la porción más minúscula de materia. Y la llamaron átomo, que significa “indivisible”. Si bien hoy sabemos que los átomos son divisibles porque están hechos de partículas más chicas, también es cierto que cuando hablamos de un compuesto, por ejemplo, una molécula, los átomos son su parte fundamental desde el punto de vista químico. Ahora bien, ¿qué cara tiene un átomo? ¿Siempre se imaginaron que tenía la misma cara? ¿Cómo se dieron cuenta de que no era tan indivisible? ¿Cómo llegaron a ponerle una cara parecida a la que tiene de verdad?
No podemos seguir hablando de átomos sin hablar de elementos. Si volvemos a Grecia, resulta que la idea de Demócrito se vio opacada por otra que se le ocurrió a Empédocles, que sostenía que la materia estaba constituida por 4 elementos fundamentales: tierra, aire, agua y fuego. Aristóteles apoyaba esta idea, y como se comenta que tenía mucha influencia por ese entonces, se decidió dejar a un lado la idea de átomo por unos módicos veinticuatro siglos. Recién cerca de 1780 apareció Antoine Lavoisier, un científico francés que, gracias a que contaba con muchos recursos económicos, pudo estudiar una cantidad enorme de reacciones químicas. Antoine trabajó codo a codo con Marie-Anne Pierrette Paulze, también conocida como madame Lavoisier, o la madre de la química moderna. Tantos experimentos hicieron que se dieron cuenta de que no había solo 4 elementos fundamentales, sino 55. Por ejemplo, estudiando la composición del agua vieron que había más de una cosa ahí adentro y por lo tanto no era tan fundamental como suponían. Así, terminaron nombrando por primera vez al oxígeno y al hidrógeno. Sus estudios dieron lugar también a la famosa frase “nada se pierde, todo se transforma”, que todo muy lindo con la conservación de la masa, pero cuando se la dije a uno de mis ex novios, se puso a llorar. Lavoisier terminó bastante peor que mi ex: lo degollaron, al son de “la República no necesita científicos”. La versión vintage y europea de “vayan a lavar los platos”.
Es curioso quizá que la primera persona en retomar la idea del átomo de Demócrito después de tantos siglos haya sido alguien que seguro nos suena mucho más por el daltonismo que por su teoría atómica. John Dalton, allá por el 1800, aseguró, entre otras cosas, que la materia estaba hecha de átomos. Seguía convencido de que el significado de la palabra era cierto, o sea, que el átomo era lo más pequeño e indestructible, pero además dijo que los átomos de un mismo elemento tienen las mismas propiedades y la misma masa, y que estas son diferentes a las de otro elemento. También dijo que estos átomos son los que se combinan para formar compuestos. Todo esto y más lo concluyó después de estudiar cómo reaccionaban entre sí diferentes gases, en base a lo cual hizo la primera tabla de masas atómicas relativas de algunos elementos. Salvo por lo de indivisible, la pegó en todo.

Cerca pero no, Dalton.
No tan indivisible
Cien años más tarde, J. J. Thomson se puso a jugar con rayos catódicos (los de las teles viejas) y, ‘destripando’ átomos, propuso que dentro de ellos había algo más chico que salía disparado, unas partículas de carga negativa que llamó ‘corpúsculos’ y que hoy conocemos como ‘electrones’. Voilà: el átomo es divisible. Como ya se sabía que el átomo es neutro, para compensar esas cargas negativas había que agregarle algo que fuera positivo. J. J. se imaginó que los electrones eran como frutos secos uniformemente distribuidos adentro de una torta con la masa toda positiva. Bien inglés, para quienes la torta galesa y el té de las cinco en punto son casi una religión.
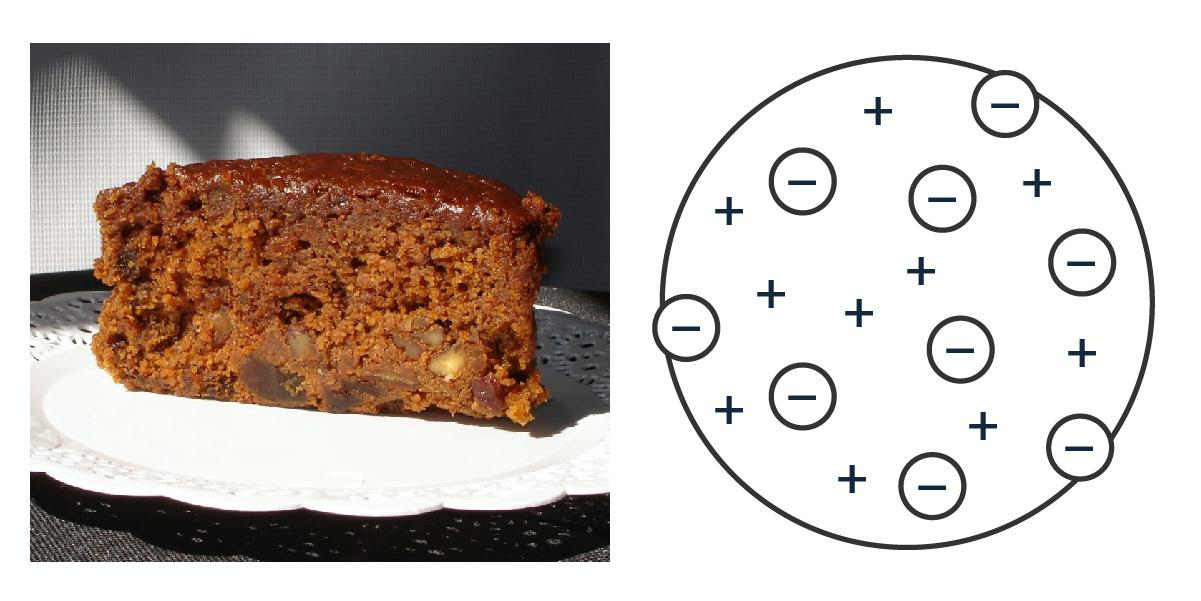
El famoso té inglés con átomo.
Es notable que, casi al mismo tiempo, Marie Curie se haya percatado de que la emisión espontánea de partículas del uranio, o “los rayos de uranio”, como los llamaba ella, hacía que el aire alrededor fuera conductor de la electricidad. Lo llamativo es que dijo que esa radiación salía de adentro del átomo de uranio, con lo cual también estaba afirmando que el átomo podía dividirse. Pero todavía faltaban algunos años de lucha feminista para que empezaran a reconocer sus observaciones.
Ernest Rutherford, un estudiante de Thomson, siguió analizando este asunto de las partículas que salen volando de forma natural de ciertos elementos, hoy más conocido como radiactividad. Después de varios experimentos en los que hacía chocar esas partículas con cosas, les puso nombre según cuánto pudieran atravesarlas: las llamó, en orden creciente de cuánto eran capaces de penetrar, radiación alfa, beta o gamma. Rutherford ya estaba medio cansado para ese entonces, así que después de que el físico alemán Hans Geiger lo visitara en su laboratorio de Canadá, le sugirió que siguiera experimentando con algunas cosas que venía pensando. Geiger y su estudiante Ernest Marsden empezaron, entonces, a jugar con las partículas alfa, las que penetraban menos, que además de ser las más rezagadas, tenían la particularidad de estar cargadas positivamente. Lo que vieron, con mucha sorpresa, fue que algunas de esas partículas se desviaban muchísimo de su camino cuando las hacían chocar con una lámina de oro muy finita. Si los átomos de oro tuvieran toda la carga repartida en el espacio de manera uniforme, como planteaba J. J. en su modelo de torta, todas las partículas alfa deberían atravesarlos sin desviarse demasiado. Pero no, algunas volvían casi en la misma dirección: rebotaban.
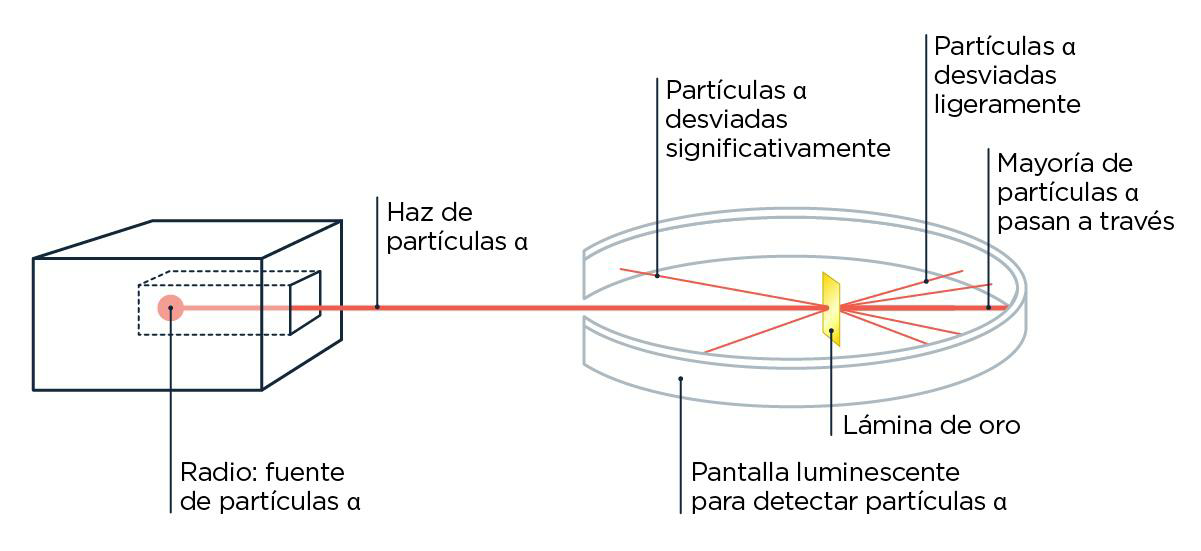
¿Qué le dijo una partícula alfa a una gamma? Cuando vos fuiste, yo fui y volví.
Estas observaciones los llevaron a ellos, y en especial a Rutherford, a una conclusión importantísima: el átomo tiene mucha carga concentrada en alguna parte. Rutherford propuso que era positiva y, además, que estaba en el medio, con los corpúsculos negativos alrededor. A ese centro de cargas positivas lo llamó ‘núcleo’ y a las partículas que le conferían esa carga las llamó ‘protones’. Así quedó establecida la idea de que el núcleo era un punto positivo en el espacio que contenía casi toda la masa del átomo, y que había cargas negativas girando alrededor muy pero muy lejos. Entre el núcleo y los electrones, un vacío enorme.
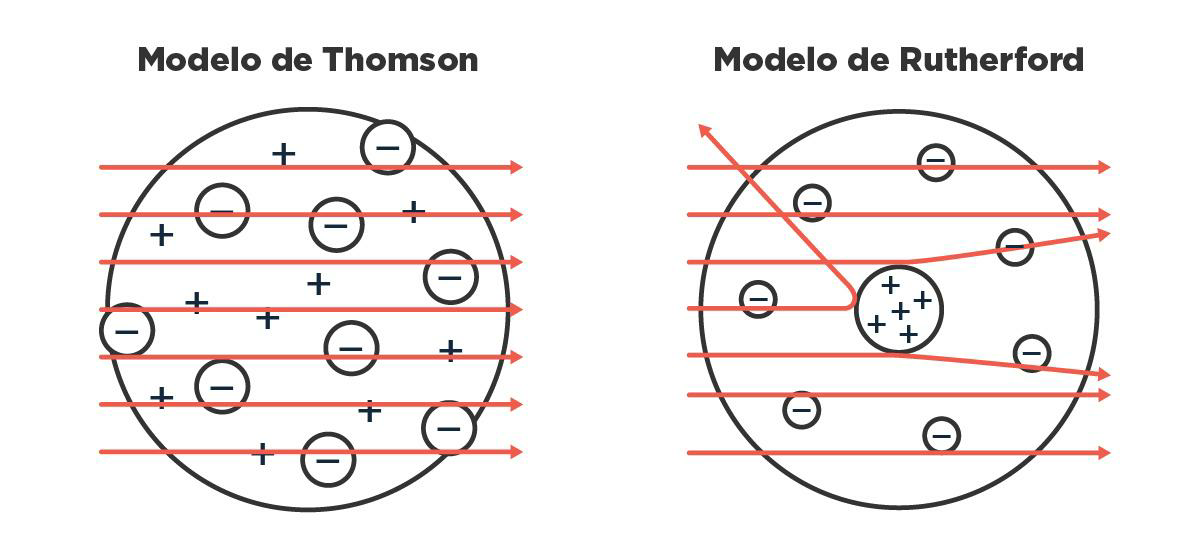
Qué les debería pasar a las partículas alfa al chocar con un átomo según el modelo de Thomson versus qué les pasaba realmente, y de cómo Rutherford lo solucionó poniendo las cargas en lugares distintos.
Por más bello que fuera, en la comunidad científica se armó alto revuelo cuando Rutherford propuso este modelo del átomo. Le dijeron de todo menos lindo:
Rutherford: Entonces, como venía diciendo, el átomo en el medio tiene muchas cargas positivas juntas.
Absolutamente todo el mundo: Pará, pará, pará… ¿vos nos estás diciendo que puede haber cargas del mismo signo todas apretadas en un mismo lugar? ¿Tas loco, hermano?
Todo esto le hacía ruido incluso a él mismo: era muy difícil, por no decir imposible, explicar en ese momento que podía existir un centro todo lleno de partículas con la misma carga y que no se repelan fuerte. No fue hasta diez años más tarde, cuando se supo de la existencia del neutrón, que estos asuntos tuvieron respuesta. Pero ¿cómo? Lo que se planteó fue que los neutrones estabilizan los núcleos atómicos y actúan como una especie de moderadores entre tanta carga positiva. Además, se postuló que todo se mantiene pegoteado gracias a unas fuerzas locas llamadas nucleares o fuerzas fuertes, que, a diferencia de la fuerza de gravedad (que es una de las fuerzas débiles), actúan solo a distancias MUY pequeñas. Y como para todo tiene que haber una partícula asociada, se llamó gluón al portador de esta fuerza, que viene del inglés glue, “pegamento”. Mucho más tarde se supo que tanto protones como neutrones en realidad están, a su vez, formados por otras partículas, los quarks. Al final fueron tantas las partículas subatómicas y subnucleónicas (no niego ni afirmo que esta palabra exista) que todo este compendio se conoce hoy como zoológico de partículas. Les juro.
Volviendo al modelo de Rutherford y al lío que armó, faltaba todo el asunto de los electrones. ¿Dónde estaban?
Rutherford: Y bueno, deben estar girando en perpetuo movimiento alrededor de ese núcleo… ¿no?
Absolutamente todo el mundo: Las leyes de la física nos dicen que si hay cosas con carga girando, es inevitable que pierdan energía, con lo cual eventualmente deberían frenar, ergo colapsarían sobre el núcleo dibujando una espiral asesina. Eso no puede vivir indefinidamente, nada existiría por el colapso y esta conversación sería eternamente introspectiva e imaginaria.
Si bien el modelo de Rutherford no lograba responder todas las preguntas (como pasa casi siempre), era el único planteado hasta el momento que servía para explicar el experimento de Geiger y Marsden.
Una historia con espectros
Para responder dónde están los electrones, hay que volver un poco para atrás en la historia. Tenemos que aprender un par de cosas de los colores y los elementos, eso que Dalton no podía ver. Para la época del modelo de torta galesa, diferentes personas notaron que cuando calentaban fuerte algunos elementos, salía luz de colores muy específicos. Es más, se dieron cuenta de que había una huella digital en colores de cada elemento. Color es sinónimo de energía: cuanto más cerca del violeta, esa luz tiene asociada más energía. Más cerca del rojo, menos. A esas huellas digitales las llamaron espectros.

Espectro de emisión del átomo de hidrógeno: líneas de colores que representan energías diferentes, consecuencia del salto del electrón entre lugares de mayor energía (alcanzados luego de calentar el átomo), a los de menor energía.
Todo esto de por sí era muy hermoso, porque representaba una herramienta poderosísima para identificar elementos, pero fue aún más hermoso cuando Niels Bohr propuso un nuevo modelo del átomo que explicaba estas observaciones. La novedad consistió en proponer que los electrones, que no sabían muy bien dónde estaban pero seguro que no pegados al núcleo, tenían que ocupar órbitas específicas (que, a su vez, establecen ciertos niveles de energía), y esas órbitas debían estar a unas distancias del núcleo muy definidas, con un número máximo de electrones por órbita.
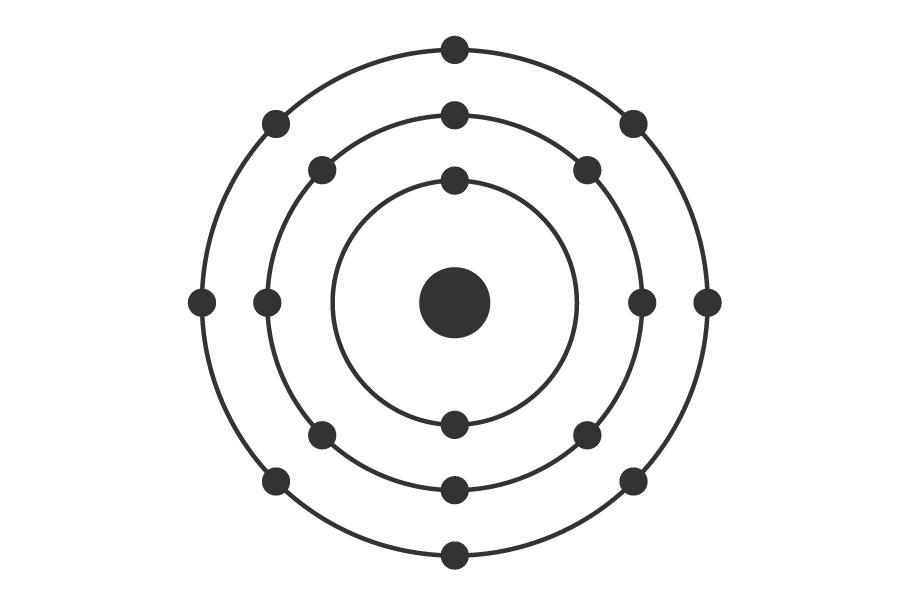
Según Bohr, esto sería un hermoso átomo de argón. Ojo que el tamaño relativo entre el protón y los electrones no está a escala. Tampoco la relación entre el tamaño del núcleo y el del átomo entero, el cual es ~20.000 veces más grande que el núcleo.
Para entonces, el formalismo de Max Planck, pionero de la mecánica cuántica cerca del 1900, pisaba fuerte. Basándose en sus ideas, Bohr estableció lugares permitidos y lugares prohibidos para los electrones. Los electrones podían saltar de una órbita a la otra, pero no podían vivir en el medio. Esos saltos traían asociados cuantos de energía, o sea, cantidades muy determinadas. Podemos pensar en una rayuela: si queremos llegar al cielo desde la tierra, tenemos que dar saltos específicos. No podemos arrastrar los pies, tampoco podemos tocar los bordes, porque perdemos. Algo así de arbitrario resultaba este modelo, con reglas tan claras como inconsistentes, pero que servía para explicar la idea de los espectros como huella digital. ¿Cómo? Esos paquetes de energía son característicos para cada elemento, y cuando salen en forma de luz, se traducen en un color. El caso más sencillo (y el único que pudo predecir de verdad Bohr) es un átomo que tiene solo un protón y un electrón, o mejor dicho, el átomo de hidrógeno. Lo que Bohr estaba planteando era que ese único electrón del hidrógeno en su estado fundamental, o sea, sin ninguna perturbación, va a vivir en una órbita circular a una distancia específica del protón, con una energía determinada. Pero si lo calentamos mucho (una forma de darle energía), va a poder ocupar otras órbitas más alejadas cuyas energías asociadas son mayores. Además, la diferencia de energía entre una órbita (nivel) y la original tiene valores súper definidos, o sea, colores, que hacen que podamos identificar de manera inequívoca al hidrógeno cuando emite luz al enfriarse. Así fue como se encontraron muchos elementos nuevos, incluido el helio, porque mirar qué color sale de una roca caliente en el laboratorio se parece mucho a mirar el sol.
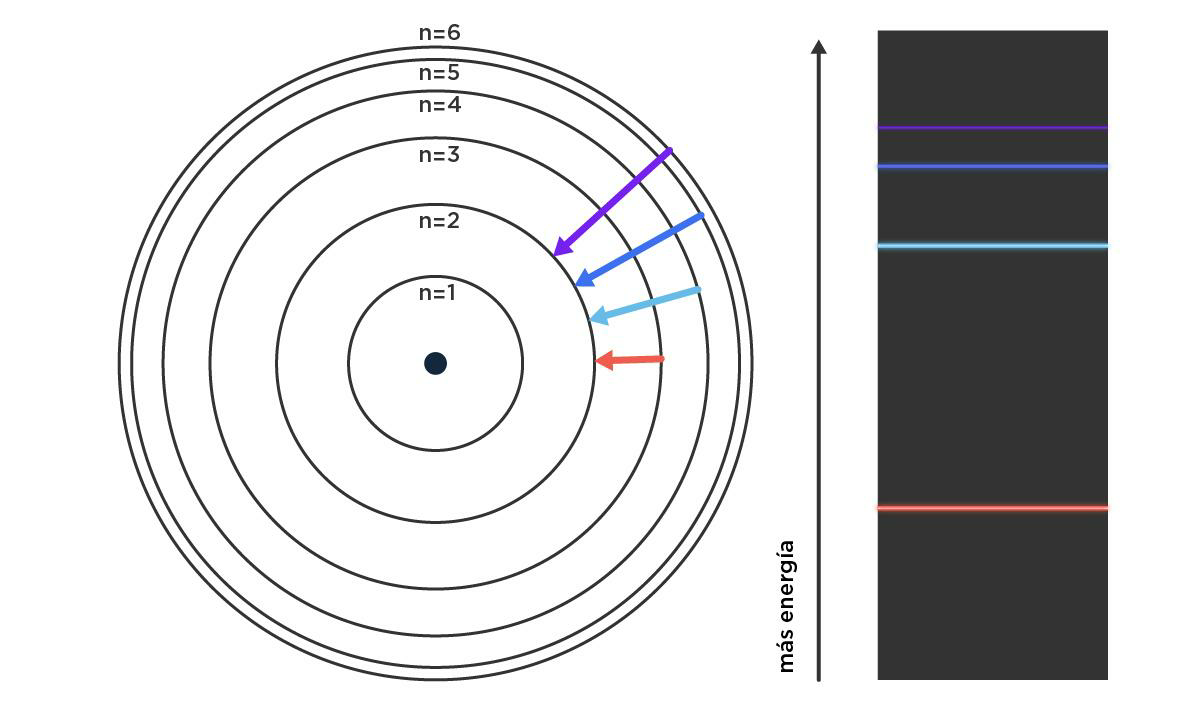
Descripción gráfica del salto del electrón del átomo de hidrógeno desde distintos niveles de energía hasta el segundo nivel, y los colores que tienen asociados esos saltos.
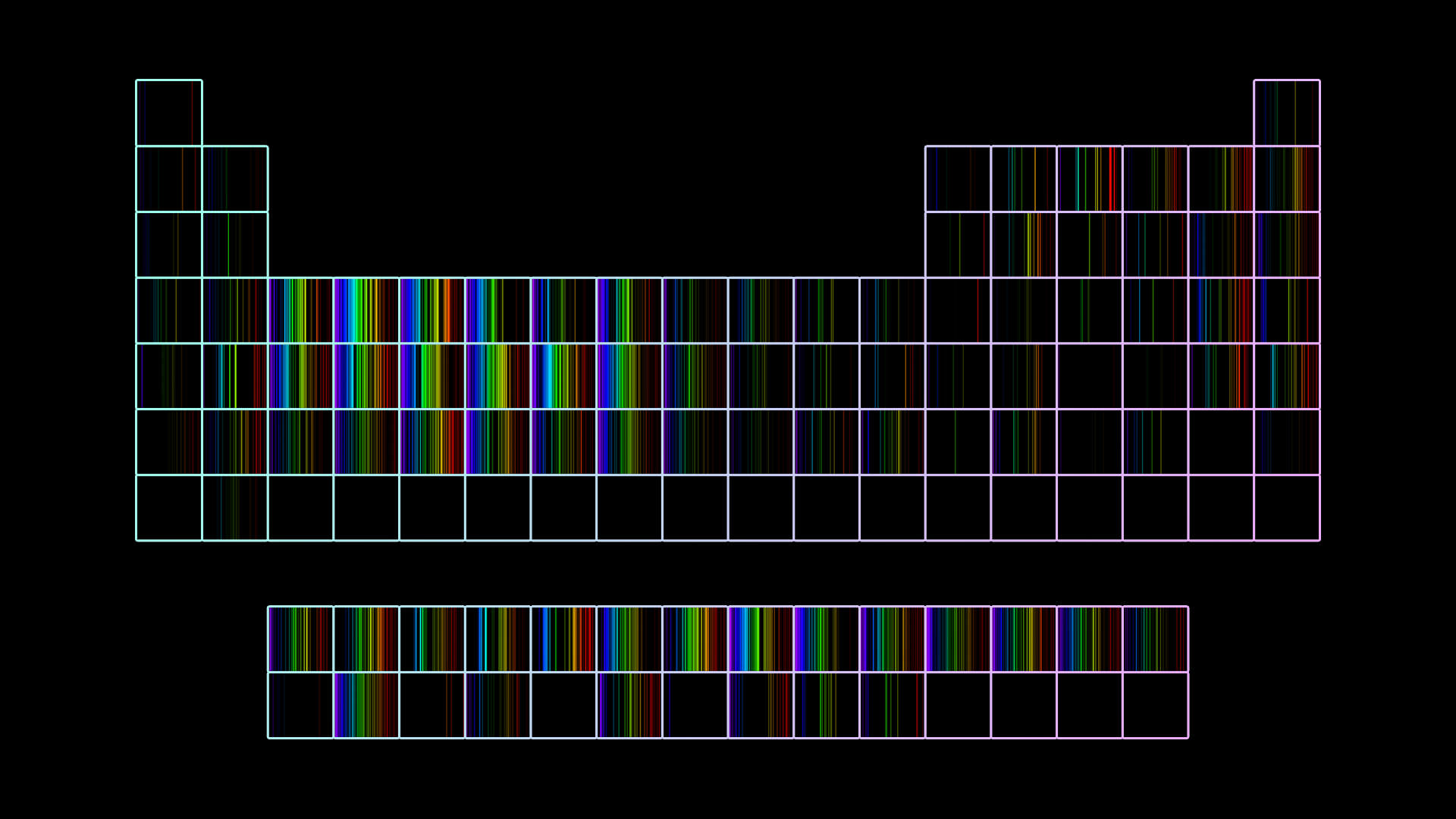
Cada elemento tiene asociado un espectro bien específico.
El modelo de Bohr fue uno de los primeros que tuvo éxito en explicar muchas cosas juntas, entre ellas, varias de las propiedades que hacen que los elementos se acomoden en la tabla periódica como lo hacen. Pero (siempre hay un pero) fallaba en algunas cuestiones importantes, cada vez más difíciles de sortear. Todo se complicaba bastante al tratar de predecir el comportamiento de elementos con más de un electrón. Por ejemplo, no podía explicar la presencia de luces de colores muy parecidos (líneas dobles), lo cual era un indicio de que dos electrones que en teoría estaban en la misma órbita en realidad no tenían la misma energía. Peor aún: el modelo tampoco podía predecir con precisión qué colores emiten los elementos más pesados. Estas complicaciones se resolvieron parcialmente un par de años después, cuando Arnold Sommerfeld agregó dos “parches” relativistas al modelo que, entre otras cosas, establecían que a partir del segundo nivel de energía (la segunda órbita desde el núcleo) el electrón también puede habitar subniveles.
Además, el modelo imponía un movimiento muy específico de los electrones, con el cual se podría saber con precisión dónde estaban en un determinado momento. Hubo varias idas y vueltas a lo largo de más o menos diez años, en las cuales se planteaba que los electrones eran partículas pero se portaban como ondas y viceversa. En palabras de Louis-Victor de Broglie: “Toda la materia presenta características tanto ondulatorias como corpusculares y se comportan de uno u otro modo dependiendo del experimento específico.” Recién cerca de 1925 Schrödinger apareció en escena y nos tiró un montón de ecuaciones (de onda) que dieron un respiro a tanta contradicción. A estas ecuaciones se sumó el planteo de Heisenberg, que decía que es imposible medir simultáneamente y con toda la precisión del mundo la posición y la velocidad de una partícula cuántica, concepto más conocido como principio de indeterminación. Esto tiene que ver con que tratar de medir cosas cuánticas se complica porque no tenemos herramientas más pequeñas que lo que queremos medir. O, en criollo, es como tratar de tocar el piano con un yunque. Dicho esto, la idea de Bohr de los electrones girando en círculo y en órbitas definidas ya no tenía mucho sentido: no podemos atrapar un electrón justo donde está, porque si lo intentamos, vamos a romper su estado cuántico y lo que vamos a medir va a ser una mezcla de lo que era y lo que provocamos tratando de medirlo.

Casitas
Entre 1925 y 1930 pasaron muchísimas cosas que apuntaron a un final feliz: la descripción más realista que se conoce hasta el día de hoy de la estructura atómica. En realidad, el mayor aporte estuvo en describir la distribución de los electrones en el espacio de una manera muy concreta y consistente con los experimentos. Con absolutamente todos.
Esta descripción completa y consistente implica introducir el concepto de orbital. Un orbital atómico es una ecuación que representa la probabilidad de encontrar electrones en una zona particular del espacio. Estas regiones pueden pensarse como nubes con formas muy características, dadas por el nivel de energía específico que representen. El electrón no está ahí o acá, está en algún lugar que puede ser cualquiera del espacio pero con una probabilidad que cambia en función del tipo de orbital. Esa probabilidad es un número: cerca de 0% si el electrón ahí casi seguro no está, y cerca de 100% si casi seguro que sí. Solo sumando las probabilidades de todo el espacio nos da 100%, o sea, seguro seguro que el electrón está en algún lugar (re informativo, ¿no?).
Los orbitales están bastante lejos de ser las órbitas circulares o elípticas que planteaban Bohr y Sommerfeld. Aparte de que no representan un lugar en el espacio definido en donde el electrón seguro va a estar, como decía Bohr de las órbitas, esas funciones de probabilidad pueden tener formas súper raras.
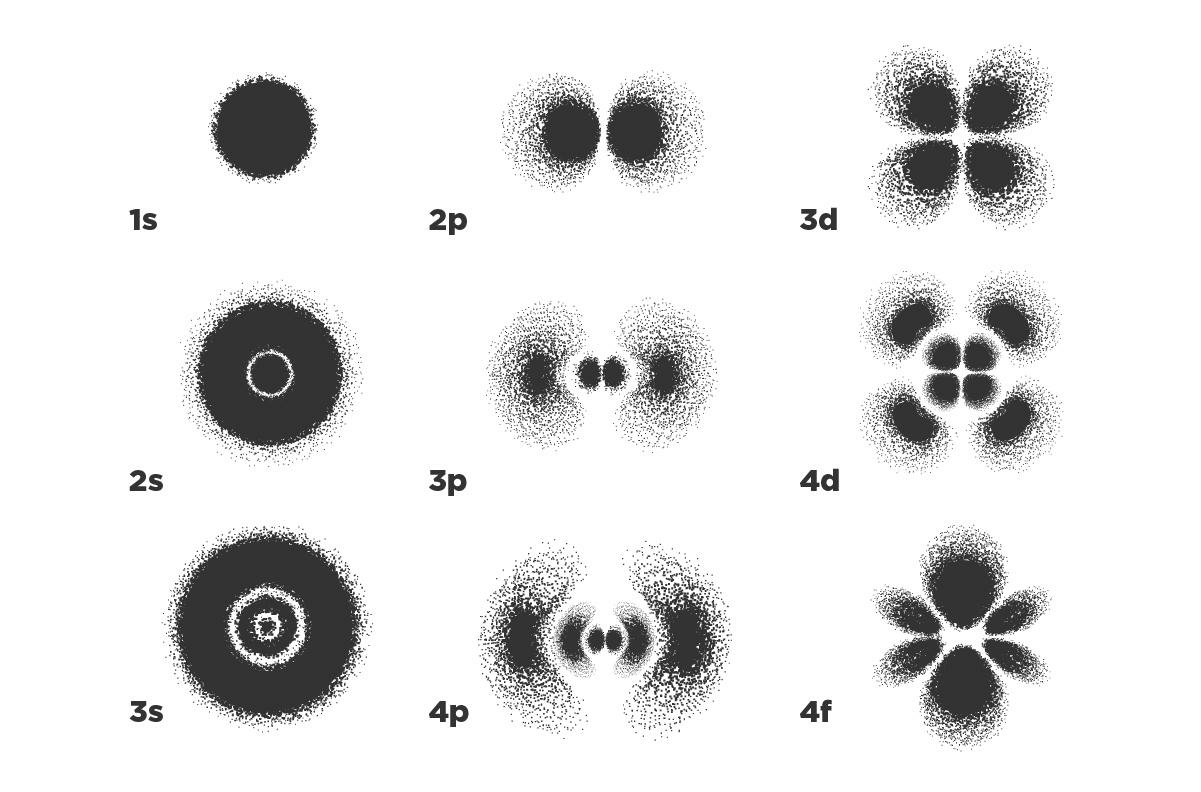
Distribuciones de probabilidad de encontrar el electrón del hidrógeno para diferentes orbitales, o sea, para distintos niveles de energía. Más negro significa que ahí va a ser más probable encontrarlo, mientras que el número nos habla del nivel de energía (1 es más bajo que 4). La letra tiene que ver con la forma de esos orbitales, y el origen de cada letra viene de la mano de cómo se ven las líneas en los espectros: s de ‘sharp’ o sea ‘agudo’, p de ‘principal’, d de ‘diffuse’ y f de ‘fundamental’.
Momentito: ¿el hidrógeno no tiene solo un electrón? ¿Por qué aparecen muchos lugares en los que podría estar? Bueno, porque justamente lo súper interesante –y a la vez complejo– es que ese electrón puede tener (bajo alguna condición, por ejemplo, si lo iluminamos) la posibilidad de ‘subirse’ a otros orbitales. Algo análogo a lo que hablábamos antes sobre llevar a los electrones a otros niveles de energía dándoles calor. Porque, en definitiva, orbital también es energía. Es decir, podemos darnos el lujo de imaginar un átomo sin sus electrones como un edificio a estrenar que tiene las casitas ahí listas para que se ocupen. Y esas casitas son los orbitales. Esto se conoce en el mundo nerd como átomo hidrogenoide.
Como quien no quiere la cosa, llegamos a la descripción matemática exacta de un elemento que tiene solo un electrón. Sin embargo, si tratamos de entender de manera ultra exacta otros átomos más gorditos, la matemática se complica bastante. Hay una aproximación que nos salva y consiste en ir llenando con electrones los orbitales de a uno, desde los que tienen más baja energía hasta los que tienen más alta (a esto se lo llama aproximación orbital). Pero hay una regla muy estricta que los electrones no pueden evitar por el hecho de ser electrones: las casitas solo pueden ser habitadas de a dos, y medio que los electrones tienen que mirar uno para cada lado. En física de partículas se sabe que hay pocas cosas más difíciles que la convivencia entre electrones. La cuestión es, entonces, que si queremos imaginarnos, por ejemplo, cómo es el litio (pista: tres electrones), podemos pensar que dos electrones habitan la primera casita (la de más baja energía) y que al tercer electrón no le queda otra que ir a la siguiente casita, que tiene más energía, y entonces ubicarse más lejos del núcleo. Esta aproximación es recontra útil para entender que si miramos con un poco de detenimiento la tabla periódica, no tenemos más que una sucesión de casilleros de izquierda a derecha en los cuales se van sumando electrones de a uno (lo que es lo mismo que sumar protones, porque ya desde hace mucho sabemos que los átomos son neutros). Entonces, es como si fuéramos ocupando cada vez más esas casitas-orbitales para formar un monoblock.
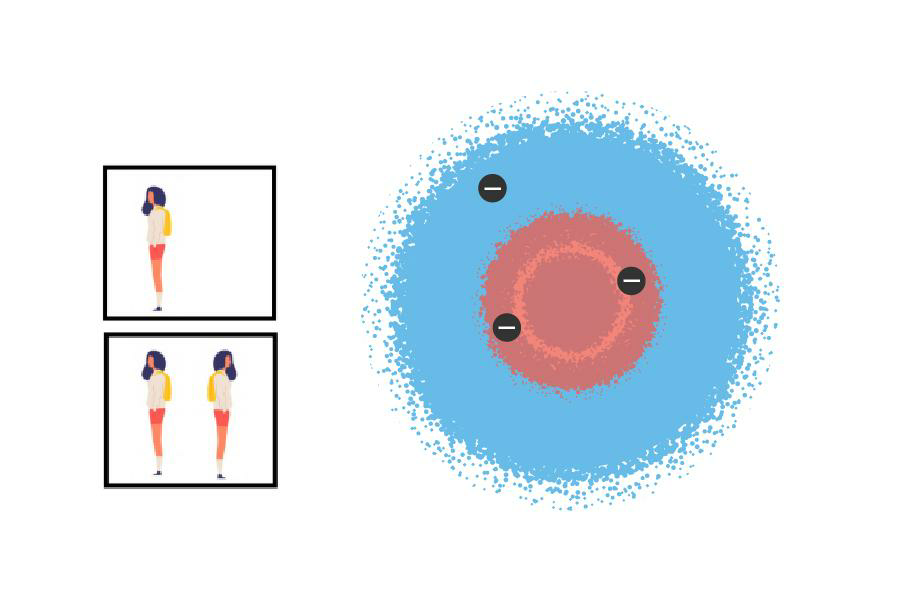
Electrones del litio en sus casitas: dos en la casa rosa (orbital 1s) y uno en la casa azul (orbital 2 s). No los ven, pero créanme: los de la casa rosa están mirando para lados distintos; convivencia difícil.
El mejor que tenemos
Mi compañero preguntón del que hablé al comienzo se quedaría muy mal si en este punto no dijera que siempre se puede hilar más y más fino, y construir modelos más y más exactos. El modelo de Schrödinger es casi perfecto, pero no es el mejor de todos. Los elementos más pesados y con más electrones necesitan que consideremos efectos locos relacionados con que esos electrones viajan a velocidades muy cercanas a la de la luz. Ese modelo ultra completo se conoce como cuántico relativista, lo desarrolló Paul Dirac, y ese sí es el mejor que tenemos (¡por fin!). Ojo, recordemos que estos últimos modelos de los que estuvimos hablando se concentran en describir los electrones, pero el núcleo también es mega importante.
Nuestra mejor imagen mental del átomo involucra, por un lado, un núcleo positivo compuesto por protones y neutrones pegoteados gracias a los gluones, que tiene concentrada casi toda la masa. Por otro lado, ese núcleo está rodeado de una nube de electrones que viven de a dos y se dan la espalda, en casitas orbitales con formas locas, lejos de ese zoológico de partículas nucleónicas, y cada vez más lejos cuanta más energía tienen. Con la parte de los electrones nos alcanza para hacer química, o sea, explicar cómo los átomos reaccionan para formar compuestos o si se terminan quedando solos. Si miramos el núcleo, podemos entender, por ejemplo, cómo y por qué algunos átomos se rompen en pedacitos de manera espontánea y de dónde sale (o de dónde viene) la energía cuando esto pasa.
En definitiva, después de conocer un poco mejor al átomo, y de navegar por su historia, es posible que nos enamoremos más de él que de la superposición de sus fotos virtuales. Ahora entendemos mejor por qué es lo que es, en su completitud y complejidad. Ahora sabemos que tiene un corazón grande, muy grande, y positivo. Y para colmo, con esos electrones alrededor, seguro hay un montón de química.





